Моноклональные антитела (mAb) для лечения рака
Преимущества моноклональных антител
Для лечения тяжелых форм псориаза назначают прием системных глюкокортикостероидов (стероидные гормоны, продуцируемые корой надпочечников), которые влияют на гормональный фон и подавляют местную иммунную систему. Моноклональные антитела воздействуют только на активные клетки псориатического воспаления и не подавляют иммунитет всего организма. Лечебный эффект — уменьшение активности воспаления.
Не меньшим преимуществом подобного лечения — двунаправленная деятельность моноклонов:
- По научному: влияние на цитокины, предназначенные для регулирования межклеточного взаимодействия, а также для передачи химических сигналов воспалительному процессу и пролиферации.
Проще говоря: мощный белок атакует злокачественные клетки и вирусные частички. - Нормализует деление клеток кожи, следовательно пропадают бляшки псориаза.
Чудо генной инженерии – человеческие моноклональные антитела
Моноклональные антитела (МАТ) сегодня применяются при лечении заболеваний, большинство из которых еще несколько десятков лет назад считались неизлечимыми. Это онкологические, аутоиммунные, сердечно-сосудистые и инфекционные заболевания, воспалительные реакции различного генеза, системный склероз, идиопатический фиброз легких, гепатит В, СПИД, ревматоидный артрит, системная красная волчанка, аллергические реакции, мышечная дистрофия, болезнь Альцгеймера, астма, диабет и другие заболевания.
Препараты, изготовленные на основе моноклональных антител, относятся к новейшим в современной медицине. С середины 90-х годов до сегодняшнего дня на мировом фармацевтическом рынке одобрено более 30 лекарственных средств, имеющих в составе моноклональные антитела. Первоначально надежность методов и технологий производства моноклональных антител и безопасность их применения вызывали опасения у фармацевтических производителей.

Однако сегодня научный и медицинский опыт показал возможность их эффективного и безопасного применения в медицине. Сейчас большинство фармацевтических компаний работают над разработкой новых препаратов и лекарственных средств на основе моноклональных антител. На этапе разработки в мире находится около 300 МАТ.
В чем же уникальность и специфика применения моноклональных антител?
Ответьте на 4 вопроса и получите индивидуальную инструкцию по лечению Псориаза
Среди недостатков лечения моноклональными антителами стоит выделить:
- высокую стоимость препаратов;
- побочные эффекты и противопоказания;
- необходимость во врачебном контроле;
Цена препаратов с моноклональными антителами в Москве:
- Стелара, раствор: 158000-224500 р. за 45 мг, одна доза препарата;
- Хумира, раствор: 49000-86300 р. за 40 мг, одна доза препарата;
- Ремикейд, лиофилизат для приготовления раствора: 43411 р. за 100 г.;
- Симпони, раствор: 61000 р. за 100 г., одна доза препарата.
Не стоит забывать, что терапия псориаза нуждается в комплексном подходе, поэтому одних лекарств недостаточно. Помимо использования моноклональных антител, существуют строгие требования к диете и проведению ежедневных гигиенических процедур.
https://www.youtube.com/watch?v=ytcopyrightru
Получите пошаговую инструкцию, диету и план лечения!
История открытия

Ученых с давних пор интересовал вопрос о том, каким образом организм создает множество различных антител, обладающих уникальной специфичностью в отношении чужеродных веществ (антигенов), и каким образом эти антитела работают. Один из первых шагов к ответу на этот вопрос был сделан группой ученых, работавших в Институте инфекционных болезней в Берлине и открывших методы лечения дифтерии.
В конце XIX века дифтерия у детей считалась смертельным неизлечимым заболеванием. Врач иммунолог-бактериолог Эмиль Беринг (Emil Behring) предположил, что лечение дифтерии может быть успешным в случае проявления естественной защитной реакции человеческого организма, а именно, если секретируемый дифтерийными бактериями токсин нейтрализовать. В 1890 г.
Беринг совместно с японским ученым Сибасабуро Китасато установили, что неиммунизированные животные могут быть защищены от токсина дифтерийных бактерий с помощью инъекции антитоксина (антитоксической сыворотки) иммунизированных животных. В 1894 г. в период эпидемии дифтерии, унесшей жизни 50 000 детей в Германии, были произведены первые 25 000 доз антитоксина для применения в лечении людей. В 1901 г.
Эмилю Берингу была присуждена Нобелевская премия за работу по сывороточной терапии. Однако на тот момент эффективность сыворотки была достаточно низкой, поскольку антитела в сыворотке вырабатывались клетками животных, а не самого пациента и вызывали лишь пассивный иммунитет. Антитоксин необходимо было вводить сразу после инфицирования, иначе было слишком поздно.
Еще одним примером использования антисыворотки в терапии людей стали исследования Чарльза Ричета (Charles Richet) и Жюля Эрикура (Jules Héricourt), применявших для лечения онкологических заболеваний антисыворотку, полученную путем иммунизации животных тканями саркомы. С середины 30-х годов практика пассивной иммунизации сошла на нет в связи с открытием антибиотиков широкого спектра действия.
В 30-х гг. появились ультрацентрифуги, позволявшие разделять антитела по размеру и форме. В 40-х гг. ученые научились сортировать антитела по электрическому заряду и размеру. Однако дальнейшая расшифровка структуры антитела была пока недоступна из-за их большого размера, в 20 раз превышавшего размер молекул белков, структуры которых к тому времени уже были расшифрованы.
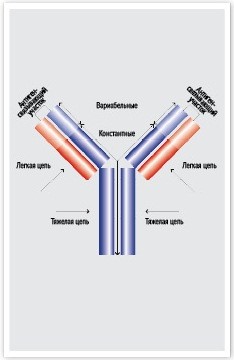
Только в 1962 г. на базе многочисленных исследований, проводившихся различными учеными, Родни Портер (Rodney Porter) расшифровал основную структуру антител, стало известно, что антитело состоит из легкой и тяжелой цепи. Позже Родни Портеру совместно с Джеральдом Эдельманом (Gerald Edelman) удалось определить последовательность 1300 аминокислот, входящих в белковую цепь антитела, производимого клетками раковой опухоли миеломы.
В то время это была самая большая расшифровка аминокислотной последовательности, за что в 1972 году ученые получили Нобелевскую премию. В результате исследований Портера и Эдельмана стало известно, что антитело имеет форму буквы Y, в которой нижняя часть (тяжелая цепь) имеет постоянную структуру для разных антител, а плечи (легкие цепи) значительно различаются у различных антител. Именно эти плечи отвечают за связывание антитела с антигеном и его нейтрализацию.
(Рисунок 1. Структура антитела, за которую ученые Родни Портер и Джеральд Эдельман в 1972 г. получили Нобелевскую премию по физиологии и медицине)
К 1970-м годам уже были известны некоторые важные моменты о том, каким образом в организме человека вырабатываются антитела. В частности, было известно, что за продуцирование антител отвечают В-лимфоциты, причем каждый В-лимфоцит может вырабатывать только одно специфическое антитело, при этом он редуплицируется и за счет этого быстро производит большое количество идентичных по структуре антител — так называемых моноклональных, то есть произошедших от одной клетки-предшественницы.
Добиться столь же быстрой выработки антител в лабораторных условиях удалось в 1975 году ученым Георгу Кёлеру (Georges Köhler) и Сезару Мильштейну (César Milstein). На тот момент была исследована способность клеток раковой опухоли миеломы быстро производить идентичные самим себе клетки. Кроме того, существовала возможность выделения антителопродуцирующих клеток из организма животных.
Технология Кёлера и Мильштейна включала несколько этапов: у мыши вырабатывался иммунитет к известному антигену, затем из ее селезенки выделялись антителопродуцирующие клетки, эти клетки с помощью особой технологии соединялись с клетками миеломы с получением гибридомы, клетки которой непрерывно в большом количестве синтезировали антитела против известного антигена.
Эта методика произвела переворот в изучении антител, поскольку позволила получать антитела с удивительно точным соответствием определенной структуре. В дальнейшем технология была усовершенствована, и в 1984 году Кёлер, Мильштейн и датский иммунолог Нильс Ерне (Niels Jerne) получили Нобелевскую премию за участие в создании антител, которые можно использовать для диагностических исследований и создания лекарственных средств.
При первых попытках применения для лечения людей антител, искусственно синтезированных из клеток животных, ученые столкнулись с трудностями. В 1979 г. впервые в мире ученые Филип Сташенко (Philip Stashenko) и Ли Надлер (Lee Nadler) применили искусственно синтезированные моноклональные антитела, полученные из клеток мышей, против антигенов, которые вырабатываются на поверхности клеток раковых опухолей.
https://www.youtube.com/watch?v=ytcreatorsru
С 1986 г. на фармацевтическом рынке началась реализация препарата компании Janssen «Ортоклон ОКТ3» (муромонаб), который позволяет купировать реакцию отторжения трансплантата почки, оказывая избирательное иммуноподавляющее действие. Препарат имеет полностью мышиное происхождение, то есть синтезируется мышиными гибридомами, полученными слиянием мышиной миеломы и мышиных В-лимфоцитов.
Вскоре после выхода препарата на рынок стало ясно, что при длительном применении мышиных моноклональных антител в качестве лекарственных средств их эффективность снижалась. Это связано с тем, что мышиные белки являются иммуногенными для организма человека, то есть воспринимаются как чужеродные объекты.
В начале 90-х гг. с использованием молекулярно-биологических методов, основанных на применении рекомбинантной ДНК, были созданы химерные антитела. В химерных антителах часть «мышиной» молекулы с помощью методов генной инженерии заменялась на участок человеческого происхождения, а часть оставалась фрагментом мышиного происхождения.
Поскольку белковая последовательность химерных антител на 75% состояла из «человеческих» последовательностей аминокислот, то у пациентов, получавших химерные антитела, HAMA-антитела образовывались в значительно меньшем количестве, и это сделало препараты на основе химерных антител значительно более эффективными, чем на основе мышиных.
В дальнейшем был выпущен целый ряд лекарственных средств на основе химерных антител: ритуксимаб, выпускаемый под брендами «Мабтера» и «Ритуксан», — для лечения раковых опухолей, «Ремикейд» (инфликсимаб) — для лечения болезни Крона, «Симулект» (базиликсимаб) — для профилактики острого отторжения трансплантата почки, «Реопро» (абциксимаб) — для профилактики стенокардии и острого инфаркта миокарда, а также другие препараты.
Разработка химерных антител позволила практически полностью отказаться от использования мышиных антител. Однако в некоторых случаях использование мышиных антител и сегодня остается оправданным. Из одобренных к применению лекарственных средств сегодня лишь три являются мышиными: «Ортоклон-ОКТ3» (муромонаб-CD3), «Зевалин» (ибритумомаб тиуксетан) и «Бексар» (тозитумомаб-йод 131).
Два последних являются радиоактивно мечеными мышиными МАТ. Их функция заключается в доставке радиоизотопов к клеткам лимфомы. Наличие радиоактивной метки позволяет применять эти антитела в очень небольших количествах, поэтому иммуногенность, обусловленная мышиными последовательностями, в этом случае не так значима.
То, что эти препараты включают именно мышиные, а не гуманизированные или человеческие формы делает их более эффективными, потому что гуманизированные формы могли бы связываться одновременно не только с клетками-мишенями, но и со здоровыми клетками, нанося им вред. Также к применению сегодня одобрен один препарат на основе крысино-мышиного МАТ — это препарат «Ремоваб» (катумаксомаб) для лечения злокачественного асцита.
В конце 90-х гг. с помощью методов генной инженерии удалось свести к минимуму процент мышиных последовательностей аминокислот в искусственно синтезируемых антителах, благодаря чему были получены гуманизированные антитела, еще в меньше степени вызывающие образование HAMA-антител у человека. Начиная с конца 90-х гг. на рынок было выпущено множество препаратов на основе гуманизированных антител.
Примеры препаратов на основе моноклональных антител:
- «Зенапакс» (даклизумаб) — для профилактики отторжения после трансплантации почки,
- «Герцептин» (трастузумаб) — для лечения рака молочной железы и рака желудка,
- «Ксолар» (омализумаб) — для лечения атопической бронхиальной астмы и сезонного аллергического ринита,
- «Раптива» (эфализумаб) — для лечения псориаза, а также многие другие.
Разработка новых моноклональных антител сегодня
Разработка лекарственного средства с использованием моноклональных антител — это очень длительный и дорогостоящий процесс. Например, первый препарат на основе мышиных антител «Ортоклон OKT3» был зарегистрирован в 1986 г., только через 11 лет после того, как мышиные антитела были впервые описаны. Первый препарат на основе химерного МАТ «Реопро» был одобрен в 1994 г.
, через 10 лет после первых работ по изучению химерных МАТ. Первый препарат на основе гуманизированного МАТ «Зенапакс» был утвержден в 1997 г., через 11 лет после первого доклада о конструкции гена гуманизированного антитела. Препарат «Энбрел» на основе слитых белков был одобрен в 1998 г., через 10 лет после описания «белков слияния». Препарат «Хумира» на основе человеческих МАТ был одобрен в 2002 году, через 12 лет после первой статьи о подобных МАТ.
https://www.youtube.com/watch?v=ytaboutru
Сегодня интерес к разработке новых препаратов на основе моноклональных антител со стороны производителей очень высок. В настоящее время на территории Российской Федерации стадию клинических исследований проходит более 10 препаратов на основе МАТ. Общее количество препаратов, находящихся на стадии разработки в мире, исчисляется сотнями.
Перед современными учеными, исследующими моноклональные антитела, стоит множество актуальных задач. В частности, поиск решения проблемы иммуногенности препаратов, изготовленных на основе МАТ. Большинство препаратов на основе МАТ, которые сегодня проходят стадию клинических исследований, включают в состав человеческие антитела.
Еще одна проблема, связанная с применением препаратов на основе моноклональных антител, обусловлена тем, что МАТ представляют собой крупные молекулы, которые не способны проникать внутрь клетки или глубоко в ткани. Сегодня МАТ нельзя применять внутрь, так как их концентрация для достижения эффекта должна в несколько тысяч раз превышать концентрацию молекул-мишеней.
В связи с этими особенностями, сегодня ученые озабочены созданием нового поколения лекарственных средств, которые объединят в себе преимущества МАТ и мелкомолекулярных препаратов. На этом пути сделано уже несколько важных научных открытий. Первое из них — создание шведской компанией Affibody особых «аффител», которые обладают свойствами обычных антител, но имеют в десятки раз меньшую молекулярную массу, что позволяет им лучше проникать в ткани.
Еще одно достижение науки — разработка «нанотел» бельгийской компанией Ablynx. Эти препараты характеризуются высокой стабильностью, что позволяет использовать их внутрь и местно. Кроме того, они просты в производстве. Сейчас на стадии клинических исследований у пациентов с тромбозами и остеопорозом находятся четыре «нанотела».
Пока что длительность и высокая стоимость производства лекарственных средств с использованием моноклональных антител делает их не всегда доступными для пациентов. Однако ученые работают над созданием новых технологий, которые позволят выпускать новые препараты быстрее и по более низкой стоимости. Благодаря современным технологиям, уже сегодня многие препараты стали доступными для большого количества пациентов и позволили излечить заболевания, ранее считавшиеся неизлечимыми.
Побочные эффекты
Применение препаратов, содержащих моноклональные антитела, вызывают следующие побочные эффекты:
- головные боли и тошнота;
- гиперемия кожных покровов (переполнение кровью сосудов кровеносной системы);
- вялость и сонливость;
- диарея;
- депрессия;
- колебания кровяного давления;
- образование тромбов;
- аритмия (нарушение ритма сердца);
- кровотечение из носа;
- отеки в легких (увеличение риска пневмонии);
- инфекции мочевых путей;
- конъюнктивит (воспаление слизистой оболочки глаза);
- зуд;
- сыпи.
Из-за нежелательных эффектов терапия моноклонами проходит под руководством и строгим контролем лечащего врача. Попытки самолечения приводят к серьезным проблемам и усугублению заболевания. С осторожностью к моноклонам следует отнестись беременным и людям с тяжелыми инфекционными болезнями (ВИЧ, гепатит, краснуха и т.п.)
Безопасны ли моноклональные антитела при псориазе?

Рассмотрим ниже 4 препарата в порядке их эффективности
Стелара
Стелара (Stelara), 45 мг/0,5 мл
Стелара применяется для терапии бляшечного псориаза средних и тяжелых форм. Биопрепарат состоит из человеческих моноклонов, что обеспечивает минимальный риск возникновения побочных эффектов.
Рекомендованная суточная дозировка составляет 45 мг. Для людей, чья масса тела превышает 100 кг, дозу увеличивают в два раза до 90 мг. Вторую инъекцию вводят через 4 недели после первой, далее инфузии вводят 1 раз в 12 недель.
Лечебный эффект от Стелара будет уже через 15-20 дней. Поддерживающая терапия гарантирует продолжительность стадии ремиссии. После 2 подкожных инъекций кожный покров очищается на 75 процентов.
Противопоказания:
- чувствительность к компонентам;
- обострение инфекционного заболевания;
- опухоли;
- беременность и грудное вскармливание;
Стоимость лекарства варьируется от 140 000 до 240 000 рублей, что не исключает риск рецидивов и появления побочных эффектов.
Моноклональные антитела не безопасны. При использовании моноклонов снижаются защитные силы человеческого организма, что сказывается на увеличении риска возникновения инфекционных и онкологических заболеваний.
Выводы
https://www.youtube.com/watch?v=ytpolicyandsafetyru
Недостатки: высокая цена, побочные эффекты, врачебный контрольПреимущества: эффективность 80%, быстрый результат, воздействие именно на причину заболевания.

Ученые не определились с причиной возникновения псориаза, однако акцент ставится на иммунные нарушения. По утверждению врачей, этот воспалительный процесс связан со сбоем в работе Т-клеток. При борьбе с псориазом важно остановить пагубное действие иммунных клеток — моноклональные антитела с этим справляются.





