Спинально мышечная дистрофия

Разные подходы к решению общих проблем у детей со спинальной мышечной атрофией
Стандартные диаграммы роста зачастую неприменимы для детей с СМА. Дети с СМА, физическое развитие которых соответствует кривым роста для «нормальных» детей, могут с функциональной точки зрения страдать ожирением или быть подвержены риску развития инсулинорезистентности и возникновения осложнений в виде метаболического синдрома.
Когнитивное и эмоциональное развитие детей с СМА является нормальным. Несмотря на то что с неврологической точки зрения речь в норме, общение, особенно с пациентами с СМА типа I, может быть затруднено из-за слабости организма. Для облегчения общения детям могут понадобиться адаптивные устройства.
Вирусные инфекции
Вследствие слабости дыхательных мышц и слабого кашля дети с СМА подвержены риску развития серьёзных инфекций верхних дыхательных путей. Членам семьи следует рекомендовать принимать соответствующие меры предосторожности (тщательное мытьё рук и ограничение взаимодействия с больными людьми). Пациентам необходимо проходить ежегодную вакцинацию против гриппа; у младенцев с СМА типа I может проводиться профилактика РСВ (респираторно-синцитиального вируса).
Дети с СМА подвержены риску развития бактериальной пневмонии как основного следствия или осложнения вирусной инфекции верхних дыхательных путей или аспирации. Рекомендуется проведение пневмококковой вакцинации, соответствующей возрасту ребёнка. Необходимыми профилактическими мерами являются использование на ранних этапах неинвазивной вентиляции лёгких и аппарата CoughAssist.
В зависимости от того, когда появляются первые
от тяжести протекания и характера атрофических изменений выделяют несколько типов заболевания.
– первому типу: острая (форма Вердига-Гоффмана);
– второму типу: промежуточная (инфантильная, хроническая);
– третьему типу: форма Кугельберга-Веландера (хроническая, ювенильная).
Три вида одного и того же заболевания возникают, по предположению специалистов, из-за разных мутаций одно и того же гена. Атрофия мышечная спинальная является аутоиммунной болезнью, которая возникает при унаследовании двух рецессивных генов, по одному от каждого родителя. Мутационный участок находится в 5 хромосоме.
Скрининг
Члены семьи
У братьев или сестёр больного с СМА вероятность присутствия этого заболевания при рождении равна 1:4, вероятность того, что они окажутся носителями СМА – 2:4. Анализ на носительство проводится у взрослых, а также братьев или сестёр больного в возрасте от 18 лет. Несмотря на то, что необходимость проведения анализа у младших братьев и сестёр больного, находящихся в группе риска, у которых не проявляются симптомы СМА, является спорной, многие эксперты считают, что раннее выявление СМА у детей может привести к улучшению клинических результатов.
Поэтому проведение таких анализов рекомендуется, если семья изъявляет соответствующее желание. Специалисты Американского колледжа медицинской генетики одобряют практику, при которой всем парам, планирующим беременность или находящимся на ранних сроках беременности, предлагают пройти анализ на ген SMN1.
Заболевание Вердина-Гоффмана
Заподозрить наличие проблемы можно еще во время беременности. Если у ребенка развивается спинальная мышечная атрофия 1 типа, то часто отмечается вялое и позднее шевеление плода при беременности. После рождения врачи могут диагностировать генерализованную гипотонию мышц.
Атрофии начинают проявляться уже в первые месяцы жизни. Часто в проксимальных отделах отмечают фасцикулярные
спины, туловища, конечностей. Также наблюдаются и бульбарные расстройства. К ним относят вялое сосание, слабый крик, нарушение процесса глотания. У детей с болезнью Вердина-Гоффмана нередко отмечают снижение рвотного, кашлевого, глоточного, небного рефлексов. У них отмечают и фибрилляцию языковых мышц.
Но это еще не все признаки, по которым может быть определена спинальная мышечная атрофия. Симптомы, характерные для 1 типа данного заболевания, включают и слабость межреберных мышц. При этом грудная клетка малышей выглядит уплощенной.
В первые месяцы жизни такие дети часто страдают от дыхательных инфекций, пневмоний и частых аспираций.

– биохимический анализ крови (в нем будет видно незначительное повышение альдолазы и креатинфосфокиназы);
– электромиографическое исследование (о поражении передних рогов спинного мозга будет свидетельствовать ритм частокола);
– гистологическое исследование скелетных мышц (выявляются скопления округлых мелких волокон).
Микроскопия спинного мозга (его передних рогов) показывает, что присутствуют дегенеративные изменения в двигательных ядрах черепно-мозговых нервов. Наблюдается шарообразное разбухание и/или сморщивание моторных клеток, микроглиальная или астроцитарная пролиферация, хроматолизис. Эти явления сопровождаются появлением плотных глиальных волокон.
Важно провести дифференциальную диагностику, чтобы исключить органические ацидурии, врожденные или структурные миопатии, например, пемалиновую, миотубулярную миопатию или заболевание центрального стержня.
Картина
Картина заболевания и клинические характеристики различаются в зависимости от подтипа СМА.
- СМА типа I (болезнь Верднига-Гоффмана) проявляется у новорождённых. Такие дети не смогут научиться сидеть или ходить, они испытывают трудности с дыханием и глотанием, в том числе с контролем секрета ротовой полости, продолжительность их жизни значительно снижена. Другие симптомы – неспособность держать голову, колоколообразная грудная клетка, слабый плач и кашель, атрофия языка и фасцикуляция (подрагивание) языка, а также парадоксальное дыхание
- СМА типа II проявляется позже на первом году жизни либо на протяжении первых 2 лет жизни. Обычно такие дети могут сидеть, но не ходить. С начальных стадий заболевания наблюдаются мелкие тремороподобные движения рук и пальцев. По мере прогрессирования слабости у детей часто возникают проблемы с дыханием и глотанием, в том числе трудности с набором веса вследствие слабости бульбарной мускулатуры, слабый кашель и ночная гиповентиляция. Было доказано, что трудности с глотанием и широким раскрытием челюсти приводят к недостаточности питания. Практически у всех детей с этим заболеванием со временем развиваются контрактуры суставов и сколиоз. Поэтому требуется упреждающее вмешательство.
- СМА типа III (болезнь Кюгельберга-Веландер) имеет в начале развития гораздо более вариабельные формы, нежели типы I и II, однако обычно проявляется в детстве или раннем подростковом возрасте. Такие дети могут сидеть и ходить (хотя некоторые из них могут со временем потерять эту способность). Как и при СМА типа II, у детей с СМА типа III могут наблюдаться мелкие тремороподобные движения рук и пальцев. Может быть выражена атрофия четырёхглавой мышцы. У детей с СМА типа III может быть меньше проблем с дыханием и глотанием, чем у детей с СМА типов I и II. У детей старшего возраста отмечаются сколиоз, контрактуры и боль в суставах.
- СМА типа 0 проявляется до рождения. В таких случаях на сроке около 30 недель выявляется пониженная подвижность плода. У новорождённых отмечаются тяжёлая гипотония, а также врождённые контрактуры, проблемы с глотанием и дыхательная недостаточность.
- СМА типа IV проявляется у взрослых и далее здесь обсуждаться не будет.
Диагностические критерии
Диагноз ставится по результатам генетического анализа на общую делецию экзона 7 гена SMN1 у детей с соответствующими клиническими симптомами. Этот анализ является недорогим и легкодоступным; лаборатории, в которых можно провести такой анализ, можно найти здесь: Анализ на СМА (GeneTests) или Анализ на СМА (Реестр генетических анализов).
Определение количества копий гена SMN2 помогает в прогнозировании и в настоящее время становится стандартной частью генетического анализа на СМА. В то время как у большинства пациентов наблюдается общая делеция экзона 7, у приблизительно 5 % детей с СМА генетический анализ оказывается отрицательным из-за делеции на 1 аллели и точечной мутации на другой. В таких случаях важную роль играют клиническое подозрение и электромиография (ЭМГ).
Болезнь Кугельберга-Веландера
Наиболее благоприятный прогноз у тех пациентов, у которых была диагностирована атрофия мышечная спинальная III типа. Она может возникнуть в возрасте от года до 20 лет. Чаще всего первые проявления регистрируют в возрасте 2-7 лет. Первыми страдают проксимальные мышцы таза.
У пациентов возникают трудности при ходьбе, беге, вставании из положения на корточках и необходимости подъема по лестнице. Стоит помнить, что клинические проявления данного заболевания в этой форме схожи с прогрессирующей дистрофией Беккера.
Проксимальные отделы рук и плечевой пояс поражаются лишь спустя несколько лет после первых проявлений болезни. Со временем деформируется грудная клетка, появляется фасцикулярный тремор кистей и неконтролируемое сокращение разных групп мышц. При этом снижаются сухожильные рефлексы и начинают прогрессировать костные деформации. Изменяется грудная клетка, стопы, голеностопные суставы, появляется сколиоз позвоночника.
Дифференциальная диагностика
Прогнозирование возможно благодаря полученным данным в результате:
- генетического анализа;
- особенностей клиники (тип болезни, место локализации);
- сопутствующие симптомы, к примеру, фасцикуляция языка;
- результатах ЭКГ и данных биопсии скелетных мышц.
Дифференцировать младенческий и ранний вид СМА можно на основании проблем с врожденной мышечной гипотонией – синдрома «вялого ребенка», амиатонии, врожденного характера доброкачественной дистрофии мышц, наследственности и хромосомного анализа.
Юношеский вид отличается от спинальной амиатрофии Кугельберга-Вееландер и разных видов мышечных дистрофий.
- СМА, как правило, легко диагностировать по клиническим симптомам и подтвердить посредством генетического анализа. Дифференциальные диагнозы для ребёнка с возникшей прогрессирующей мышечной слабостью описаны ниже.
Ботулизм детского возраста возникает у детей в возрасте до 12 месяцев. Симптоматика начинает проявляться с запора у ребёнка, ранее не имевшего проблем со стулом, и сопровождается ослаблением мимики (выразительных движений лица), проблемами с глотанием, слабым плачем и снижением подвижности. По мере развития заболевания оно проявляется более остро, чем СМА. Диагноз ставится на основании клинических симптомов и выявления наличия ботулинического токсина в стуле ребёнка.
Нейропатии охватывают широкий спектр синдромов с различной динамикой. Как правило, поражаются чувствительные нервы. Подтверждение предрасположенности к таким заболеваниям часто можно найти в семейном анамнезе (например, болезнь Шарко-Мари-Тута или наследственная двигательная и чувствительная нейропатия). Приобретённые нейропатии, такие как синдром Гийена-Барре, развиваются стремительно – на протяжении от нескольких дней до одной недели. Они крайне редко возникают у детей в возрасте до 2 лет. Диагноз подтверждается по результатам ЭМГ и (или) анализов, указывающих на повышение уровня белка в спинномозговой жидкости (СМЖ).
Метаболическая миопатия (например, митохондриальная миопатия, болезнь Помпе) намного менее распространена, чем СМА, однако клинические проявления на ранних стадиях могут быть похожими. У детей с болезнью Помпе наблюдается тяжёлая прогрессирующая сердечная дисфункция, не характерная для СМА. Мышечная дистрофия Дюшенна возникает только у мальчиков.
При этом заболевании наблюдается увеличение икроножных мышц, чрезвычайно высокий уровень креатинкиназы (КК), часто присутствует задержка в развитии. Диагноз ставится на основании генетических анализов на мутации гена DMD (гена дистрофина). X-сцепленная СМА и СМА с расстройством дыхания (СМАРД) могут по клиническим симптомам быть схожими с СМА, однако у этих заболеваний иная генетическая этиология.
СМАРД1 проявляется в виде дистальной (а не проксимальной) мышечной слабости. При этом наблюдается деформация стопы, а также дыхательная недостаточность, наступающая зачастую внезапно. Это заболевание вызывается мутациями гена IGHMBP2 , локализованного на длинном плече 11-й хромосомы 11q13.3, кодирующего белок 2, микросвязывающий иммуноглобулины.
У детей с X-сцепленной СМА в семейном анамнезе может присутствовать наследование Х-сцепленных заболеваний, и анализы таких детей на SMN1 будут отрицательными. С данными фенотипами ассоциируется всё больше новых генов, и в случае каких-либо подозрений рекомендуется обратиться для обследования в узкоспециализированную клинику.
Врождённая миопатия проявляется в виде непрогрессирующей слабости. Она диагностируется на основании биопсии мышц.
Важные признаки
Как правило, болезнь Вердина-Гоффмана диагностируют в первые месяцы жизни. Если у ребенка отсутствуют движения с рождения, то он не доживает даже до месячного возраста.
Слабость и сокращения мышц в младенческом возрасте, тремор рук и задержка двигательного развития, должны насторожить и врачей, и родителей. Такие дети не встают на ноги. Лишь четверть всех больных может стоять с поддержкой. Малыши прикованы к инвалидному креслу.
Но сложнее всего определить болезнь Кугельберга-Веландера. Ведь у четверти пациентов выраженной является гипертрофия мышц. Поэтому им ошибочно может быть диагностирована мышечная дистрофия, а не спинальная мышечная атрофия. Причины данного заболевания установлены были в 1995 году, когда удалось выявить мутирующий ген SMN.
Краткие клинические советы и предупреждения
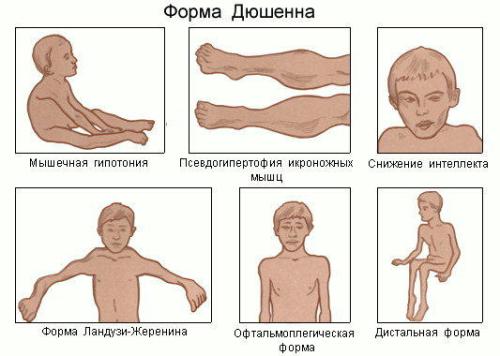
Болезнь Дюшенна
Мышечная дистрофия Дюшенна в Википедии определяется как наиболее тяжелая и распространенная форма прогрессирующих миопатий. Ее особенностями являются ранняя манифестация (в возрасте 2–3 лет) и быстро развивающаяся слабость проксимальных мышц вначале нижних, а позже и верхних конечностей.
Больные дети обычно ходят вразвалку, на пальцах, имеют выраженный лордоз. Им сложно вставать с пола, прыгать, бегать, подниматься по ступенькам. Характерны частые падения с переломами рук или ног (почти у 20% больных детей). Характерно стабильное прогрессирование слабости, практически у всех детей развивается сколиоз, сгибательные контрактуры конечностей и достоверная псевдогипертрофия (замещение отдельных групп мышц жировой/соединительной тканью).
Специфической особенностью дистрофии Дюшенна является вовлечение в патологический процесс сердечной мышцы (в 90% случаев) с развитием дилатационной кардиомиопатии, сопровождающейся нарушениями проводимости, реже аритмией.
Еще одной особенностью является легкое непрогрессирующее слабоумие, затрагивающее вербальные способности и вызывающее нейроповеденческие расстройства (синдром гиперактивности и дефицита внимания, расстройства аутистического спектра, отклонения в когнитивных функциях и др.), что затрудняет процесс обучения ребенка. Большинство детей прикованы к инвалидной коляске и умирают от осложнений к 20 годам.
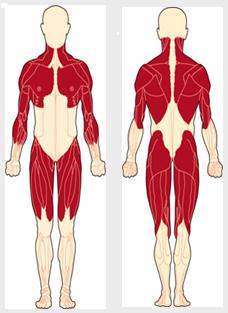
Вовлекаемые мышечные группы при миодистрофии Беккера
По клинической симптоматике она во многом напоминает форму Дюшенна, однако протекает более доброкачественно. Манифестирует эта врождённая позднее, в возрасте 10-15 лет, протекает мягко, пациенты сохраняют работоспособность на протяжении длительного периода, в 20-30 лет, иногда и позже могут еще ходить.
Фертильность не страдает, поэтому иногда заболевание прослеживается в 2-3 поколениях (“эффект деда”) — больной мужчина передает через свою дочь заболевание внуку. Заболевание прогрессирует медленно. Реакция ахилловых сухожилий менее резко выражена. Сердечно-сосудистые расстройства отсутствуют или выражены умеренно (кардиалгии, блокада ножек пучка Гиса). Интеллект сохранен.
Манифестирует в возрасте 10-20 лет. Атрофии и мышечная слабость локализуются в мимической мускулатуре лица, плеч и лопаток. Лицо становится гипомимичным (толстые, вывороченные губы, «полированный» лоб, «поперечная» улыбка). Атрофии мышц плеча и трапециевидной мышцы вызывают появление специфических симптомов («крыловидных» лопаток, симптом свободных надплечий, сколиоза, уплощения грудной клетки).
Характерно сочетанное поражение глазодвигательных мышц с выраженной слабостью мышц глотки/языка. Особенностью является позднее начало (в 40-60 лет). Манифестирует первоначально двусторонним птозом с последующим развитием расстройства глотания.
Возможные меры против дыхательной недостаточности
Дети с СМА типа I подвержены дыхательной недостаточности вследствие инфекции или аспирации (попадания инородного тела в дыхательные пути). Во избежание чрезвычайных ситуаций следует как можно раньше обсудить такую возможность с семьёй больного, а также принять профилактические меры (например, неинвазивная вентиляция лёгких, устройство CoughAssist (аппарат, очищающий дыхательные пути путём имитации настоящего кашля), использование гастростомической трубки). Частые пневмонии или заболевания органов дыхания могут свидетельствовать о предстоящей дыхательной недостаточности или аспирации.
Выжидательная тактика при посещении больницы приводит к улучшению результатов
Выжидательная тактика включает в себя повышенное внимание к питанию и состоянию дыхательной системы до и после хирургического вмешательства, а также во время срочных посещений больницы при обострениях. Полезным может оказаться временное использование назогастрального или назоеюнального зонда либо периферическое или полное парентеральное питание.
Составление письменных планов по уходу облегчает оказание экстренной помощи
Посещение пунктов неотложной помощи довольно сложно для семей детей с СМА, равно как и с любым другим сложным заболеванием, т.к. семьям необходимо подробно описать историю развития заболевания и их предпочтения в отношении ухода за ребёнком, а также причину обращения за помощью. Необходимо составлять планы действий в случае возникновения дыхательной недостаточности и пересматривать такие планы в ходе несрочных приёмов врача на дому.
Раннее послеоперационное стимулирование способности передвигаться помогает сохранить мышечную силу
Требование сохранения неподвижности после серьёзной операции (например, по устранению сколиоза или вывиха бедра) может привести к потере способности передвигаться. В этих условиях раннее восстановление способности передвигаться может оказать существенную помощь в сохранении мышечной силы.
Тактика лечения
К сожалению, атрофия мышечная спинальная является аутоиммунным заболеванием, развитие которого не получится предотвратить. Осложняет ситуацию и тот факт, что специфического лечения не существует.
В ряде случаев врачам лишь под силу немного облегчить состояние пациентов с помощью физиотерапии. Улучшить качество их жизни позволяют специальные ортопедические приспособления.
Особое внимание должно уделяться питанию таких больных. Часто назначают препараты, способные улучшить метаболизм. Но это еще не все, что можно сделать, если была подтверждена спинальная мышечная атрофия. Лечение заключается и в назначении гимнастики. Физические нагрузки для таких больных важны. Они необходимы для того, чтобы улучшить функционирование мышц и нарастить их массу.
Анамнез и обследование
Раннее выявление слабости имеет критическое значение для первичного обследования. У маленьких детей диагностика мышечной слабости может быть затруднена, однако пристальное внимание к функциональным возможностям позволяет дать более или менее точную оценку. На сайте Организации детских мышечных заболеваний можно ознакомиться с видеоматериалами о детях с нормальными и с ослабленными мышцами. Такие материалы могут быть полезными для выявления неярко выраженной слабости.
Семейный анамнез
СМА – это аутосомно-рецессивное заболевание, которое возникает, как правило, у людей, в семейном анамнезе которых его не было; однако медицинским работникам следует осведомиться о детской и младенческой смертности в семейном анамнезе и кровном родстве.
Несмотря на отсутствие конкретных проблем в анамнезе беременности, иногда матери детей с СМА типа I сообщают о снижении подвижности плода на поздних сроках беременности. У детей с СМА типов 0 и I могут при рождении возникать артрогрипоз и трудности с кормлением, также у них может наблюдаться колоколообразная грудная клетка.
Со стороны желудочно-кишечного тракта/питания: является ли достаточным увеличение массы тела? Задайте вопросы о таких проблемах со стороны желудочно-кишечного тракта, как рефлюкс, боль в желудке и запор. У детей с нейромышечными заболеваниями, в том числе СМА, страдают остеопенией. В организм поступает достаточное количество кальция и витамина D?
Есть ли переломы? Со стороны дыхательной системы: задайте вопросы о проблемах с дыханием у детей во время бодрствования, в том числе во время приёма пищи. Осведомитесь о наличии в анамнезе пневмонии, об интенсивности кашля, наличии реактивных заболеваний дыхательных путей, о результатах последних анализов функции лёгких (оксиметрия), использовании аппаратов поддержки дыхания (такие неинвазивные аппараты поддержки дыхания, как CPAP (аппарат, обеспечивающий постоянное положительное давление в дыхательных путях) и BiPAP (аппарат, обеспечивающий двухфазную вентиляцию с положительным давлением в дыхательных путях), а также аппараты ночной или постоянной вентиляции лёгких) и использовании устройства CoughAssist.
Также задайте вопросы касательно сна, о результатах предыдущих исследований сна, наличии храпа, свидетельствующего об обструктивном апноэ сна и гиповентиляции, о частоте ночных пробуждений, дневной сонливости и утренних головных болях. Проверьте историю иммунизации, в том числе пневмококковой вакциной и вакциной против гриппа.
Проблемы с глотанием: задайте вопросы о кашле и удушье во время приёма пищи и питья (особенно негустых жидкостей) и интенсивности кашля. Спросите, есть ли дома у больного аспирационный аппарат. Со стороны опорно-двигательной системы: задайте вопросы о последних изменениях мышечной силы, утомляемости и функциональных возможностей.
Спросите о том, насколько удобными в использовании являются инвалидное кресло, приспособление для помощи при вставании и другое оборудование, а также об их техническом обслуживании. Спросите, есть ли у семьи специальный номерной знак или табличка для лиц с ограниченными возможностями.Ортопедия: задайте вопросы об использовании ортопедических аппаратов, боли в суставах, диапазоне движений и наличии переломов в анамнезе.
Развитие и обучение
Ранние этапы двигательного развития, например, способность держать голову, часто наступают с задержкой. Лёжа на спине, дети могут оставаться в классической позе «лягушки». Задержки развития речевых и языковых навыков не будет. Результаты тестирования развития свидетельствуют о существенной задержке навыков крупной моторики, но когнитивные навыки развиваются в нормальном режиме.
Исследование ежедневного функционирования организма, например, Педиатрическая оценка ограниченности возможностей (PEDI) (платно), может помочь оценить динамику развития функциональных возможностей ребёнка. Часто такое обследование предлагается врачом ребёнка. В идеале, результаты таких обследований должны указываться в материалах Medical Home.
Задайте вопросы об оказываемой ребёнку поддержке со стороны семьи и сообщества, о его доступе к необходимым ресурсам и любых других социальных вопросах, касающихся ребёнка и его семьи. Создаются ли необходимые условия в школе? Остаётся ли с ребёнком кто-то в те моменты, когда родители отсутствуют? Испытывает ли ребёнок с СМА трудности с дыханием без использования вспомогательных аппаратов или при использовании BiPAP, как это сказывается на семье, каково мнение членов семьи относительно последующих действий? Рассматривалась ли вероятность возникновения острого респираторного заболевания, и был ли намечен план действий в этом случае?
Разные подходы к решению общих проблем у детей со спинальной мышечной атрофией
Спинальные мышечные атрофии характеризуются дегенерацией периферических двигательных альфа-нейронов спинного мозга и ствола головного мозга. СМА представляют собой гетерогенную группу прогрессирующих заболеваний генетической природы, которые имеют чаще аутосомно-рецессивный (А-Р), реже — аутосомно-доминантный (А-Д) или Х-сцепленный тип наследования. Частота СМА 1 на 6000–10 000 новорожденных.
Врачи, выявляющие симптомы слабости и диффузной гипотонии у детей, должны иметь в виду высокую вероятность диагноза СМА. Дегенерация мотонейронов в спинном мозге, двигательных ядрах ствола мозга приводит к возникновению симметричного вялого паралича поперечнополосатых мышц конечностей и туловища. В классических вариантах отмечаются преимущественное преобладание слабости в проксимальных группах мышц, чем в дистальных, большая слабость в ногах, чем в руках, симметричность снижения силы, отсутствие нарушений чувствительности, снижение или отсутствие сухожильных рефлексов. Как правило, выраженность слабости коррелирует с возрастом начала заболевания.
Наибольшую распространенность имеют проксимальные формы с аутосомно-рецессивным типом наследования, которые составляют 80–85 % от всех наследственных СМА. Дистальные спинальные амиотрофии составляют не менее 10 % всех СМА. Учитывая, что распространение мышечной слабости при дистальных СМА сходно с таковым при поражении периферических нервов, ряд авторов обозначает дистальные СМА как дистальные наследственные моторные нейронопатии (dHMN).
Диагностические критерии основных СМА, варианты инфантильных форм СМА, терапевтическая стратегия и модификация, основанные на результатах картирования генов и предродового диагноза, были предложены International SMA Consortium, 2007, 2012 (ISMAC). Наиболее адекватной классификацией является та, в основе которой лежит принцип различия генных мутаций, в том числе в так называемом SMN-гене (ген выживания мотонейрона) (табл. 2).
Для удобства описания проводится также условное выделение 2 основных групп СМА: изолированные и сочетанные (табл. 3).
Изолированные СМА включают все нозологические формы, при которых симптомокомплекс поражения передних рогов спинного мозга служит ведущим и в большинстве случаев единственным клиническим проявлением. В рамках этой группы традиционно выделяют подгруппы, различающиеся по локализации мышечных атрофий.

Под сочетанными СМА подразумеваются те редкие клинические варианты заболеваний, которые характеризуются комбинацией периферического вялого паралича с другой неврологической симптоматикой, а также поражением других органов и систем и необычной комбинацией симптомов.
Электронейромиографический (ЭНМГ) маркер СМА: характерные признаки денервации, вследствие поражения мотонейронов — спонтаннная ритмическая активность («ритм частокола»), потенциалы фибрилляций, потенциалы фасцикуляций, положительные острые волны, изменение потенциалов двигательных единиц с формированием гигантских полифазных потенциалов, уменьшение числа двигательных единиц.
При морфологическом исследовании мышц выявляются специфические признаки мышечного поражения в виде избыточной неравномерности диаметра мышечных волокон: скопления уменьшенных в размере волокон (пучковая атрофия), чередуются с участками гипертрофированных волокон.
Заболевание встречается в трех аллельных вариантах, различающихся возрастом начала и тяжестью клинического течения. I вариант описан G. Werdnig в 1891 году, II промежуточный вариант предложил Dubowitz, III вариант — E. Kugelberg и L. Welander в 1956 году. Тип наследования — аутосомно-рецессивный.
Гены, ответственные за возникновение всех трех вариантов заболевания, картированы в области хромосомы 5q12.2-q13.3. Эта область представлена инвертированным повтором и включает по крайней мере четыре гена, мутации в которых могут иметь значение в развитии заболевания или модифицировать тяжесть его течения.
Ген SMN (теломерная копия, MIM: 600354) имеет 9 экзонов, из которых один (8-й экзон) не транслируется. Более 95 % больных с I–III вариантами СМА имеют делецию 7-го и/или 8-го экзона теломерной копии SMN-гена в гомозиготном состоянии. Остальные пациенты являются компаунд-гетерозиготами и имеют делецию в одном из этих генов, в то время как в другом гене, расположенном на гомологичной хромосоме, обнаруживаются сплайсинговые или миссенс-мутации.
Второй ген, расположенный в этой области, — NAIP (ген ингибитора нейронального апоптоза, MIM: 600355) также имеет копии. Данный ген содержит 16 экзонов. Делеции одного или нескольких экзонов этого гена в гомозиготном состоянии встречаются у 40–70 % больных с I типом СМА и у 14–22 % больных с II и III типом СМА. У подавляющего числа больных, имеющих делецию 7-го и 8-го экзонов SMN-гена в гомозиготном состоянии, обнаруживается также делеция и в гене NAIP.
Четвертый ген, вовлеченный в процесс возникновения заболевания, — ВTF2p44 также представлен несколькими копиями. Показано, что 15 % больных с различными типами СМА имеют делецию этого гена в гетерозиготном состоянии.
Таким образом, ведущим этиологическим фактором проксимальных СМА является наличие делеции в гомозиготном состоянии в теломерной копии SMN-гена. Факторами, модифицирующими тяжесть течения заболевания и приводящими к возникновению аллельных вариантов проксимальных СМА, являются: 1) количество центромерных копий SMN-гена (две при I типе СМА и от трех до пяти при II и III типах СМA); 2) наличие делеций в генах NAIP и H4F5. Не исключено существование других модифицирующих механизмов.
Кодируемый геном SMN белок содержит 294 аминокислотных остатка и экспрессируется во всех тканях организма. Наибольшее количество белка обнаружено в мотонейронах спинного мозга. В цитоплазме и ядре соматических клеток SMN ассоциирован с другим белком — SIP1. Вполне вероятно, что этот белок необходим для регенерации и повторных циклов образования мРНК, поскольку при наличии мутации в SMN-гене этот процесс у больных нарушен.
I тип проксимальных СМА с аутосомно-рецессивным типом наследования — болезнь Верднига — Гофманна возникает с рождения до 6-месячного возраста и характеризуется тяжелым злокачественным течением. Первые признаки заболевания можно отметить еще во внутриутробном периоде по слабому шевелению плода. При врожденном варианте болезни уже в неонатальном периоде отмечаются выраженная мышечная гипотония, гипотрофия с преимущественным поражением проксимальных отделов ног, угасание сухожильных рефлексов, фибриллярные подергивания мышц языка и пальцев кистей.
Дети никогда не держат голову и не переворачиваются. Отмечается своеобразная поза ребенка (поза лягушки): конечности отведены в плечевых и тазобедренных суставах и согнуты в локтевых и коленных. Первыми поражаются мышцы проксимальных отделов нижних конечностей, процесс имеет восходящее распространение.
Вовлечение дыхательной мускулатуры (межреберных мышц и диафрагмы) приводит к возникновению деформации грудной клетки по типу седловидной, воронкообразной или килевидной, а также сколиоза и кифоза в грудопоясничном отделе позвоночника. По мере прогрессирования заболевания поражение распространяется на мышцы гортани и глотки вследствие вовлечения в процесс ядер каудальной группы черепных нервов.
При этом варианте СМА возможно появление первых признаков болезни в более старшем возрасте, но не позже 6 месяцев. В этих случаях дети могут держать голову и даже переворачиваются, однако никогда самостоятельно не садятся. Отмечена корреляция между временем появления первых признаков заболевания и продолжительностью жизни.
Большинство больных с врожденным вариантом болезни погибают при явлениях сердечной или дыхательной недостаточности, а также от присоединившихся инфекций на первом году жизни. В целом при этой форме СМА продолжительность жизни ограничена 2 годами. Считается, что только 10–12 % больных переживают пятилетний возраст.
II тип заболевания характеризуется более поздним началом (от 6 до 12 месяцев) и менее злокачественным течением. Для больных характерен период нормального раннего развития: больные удерживают голову, самостоятельно садятся, однако самостоятельно не ходят. Для этой формы заболевания характерны фасцикулярные подергивания кистей, языка, плечевого и тазового пояса, тремор кончиков пальцев вытянутых рук, контрактуры в суставах и деформации позвоночника. Продолжительность жизни больных увеличена по сравнению с I типом болезни и в среднем составляет 10–12 лет.
III тип проксимальных СМA — болезнь Кугельберга — Веландера возникает в широком возрастном диапазоне от 12 месяцев до 20 лет. Наиболее часто первые признаки болезни появляются в возрасте 2–7 лет в проксимальных группах мышц тазового пояса. Больные начинают испытывать трудности при ходьбе, беге, подъеме по лестнице и подъеме из положения на корточках.
В этот период клинические проявления заболевания имеют значительное сходство с таковыми при прогрессирующей мышечной дистрофии Беккера. Сходство дополняется возникновением у 18–25 % больных этим вариантом СМА псевдогипертрофий икроножных мышц, а также выраженного лордоза в поясничном отделе позвоночника.
Разные подходы к решению общих проблем у детей со спинальной мышечной атрофией
Первые симптомы появляются в 6–24 мес. в виде билатерального пареза ног. Дистальная слабость перонеальных мышц и разгибателей пальцев ног, гипотония и атрофии, снижение и/или отсутствие сухожильных рефлексов. Деформации стоп. Трудности при ходьбе и частые падения. Заболевание медленно прогрессирует с распространением на проксимальные отделы конечностей ног и рук, мышцы туловища и диафрагмы.
Однако всегда слабость превалирует в ногах и дистальных отделах конечностей. Дыхательные нарушения прогрессируют до острого респираторного дистресса. Парез мышц туловища ведет к гиперлордозу, сколиозу. Деформации грудной клетки нет. Больные имеют нормальный интеллект. Краниальные мышцы интактны, чувствительных нарушений, фасцикуляций, пирамидных знаков нет.
Спинальная амиотрофия врожденная непрогрессирующая с преимущественным поражением ног

Впервые описана Frijns et al. в 1994 году. Тип наследования — аутосомно-доминантный. Ген локализован в хромосоме 12 q23-q24.
Первые проявления заболевания обычно выявляют к 15–18 месяцам жизни по задержке темпов приобретения навыков самостоятельной ходьбы. Обычно дети начинают самостоятельно ходить после полутора лет и имеют варусную деформацию стоп. Походка больных напоминает степпаж. По мере прогрессирования заболевания формируется эквиноварусная установка стоп и отмечается восходящий тип распространения мышечной слабости с постепенным вовлечением отводящих мышц бедер и формированием контрактур в коленных суставах.
Характерным ЭНМГ-признаком заболевания являются гигантские моторные потенциалы действия при нормальных значениях скоростей проведения импульса по моторным и сенсорным волокнам периферических нервов.
У ряда больных обнаруживаются пограничные с нормой значения активности креатинфосфокиназы. При морфологическом исследовании биоптатов мышц выявляется характерная для спинальных амиотрофий пучковая атрофия волокон, преимущественно I типа.
Спинальная амиотрофия с глазодвигательными нарушениями и эпилепсией
Заболевание описано Oка с соавт. в 1995 году. Тип наследования — аутосомно-рецессивный.
Первые проявления отмечаются в период новорожденности и характеризуются прогрессирующей генерализованной спинальной амиотрофией с характерными фасцикуляциями скелетных мышц и языка, сухожильной гипорефлексией и гипотонией. У детей часто возникают колебания температуры тела. К 6 годам к указанным симптомам присоединяются глазодвигательные нарушения в виде наружной офтальмоплегии и тонико-клонические судороги.

На ЭНМГ выявляются типичные изменения мотонейронов передних рогов спинного мозга.
Морфология: избыточная неравномерность диаметра мышечных волокон.
Врожденная скапулоперонеальная спинальная амиотрофия
Впервые описал De Long {amp}amp; Siddique в 1992 году. Тип наследования — аутосомно-доминантный. Ген заболевания, обозначаемый как SPSMA (скапулоперонеальная спинальная мышечная атрофия), картирован на хромосоме 12q24.1-24.31.
Заболевание возникает с рождения и характеризуется врожденной гипоплазией мышц, симптомами спинальной амиотрофии, наиболее выраженными в области надостных и подостных мышц и мышц перонеальной группы. У большинства больных возникает стридорозное дыхание, обусловленное параличом голосовых связок. По мере прогрессирования заболевания признаки мышечной слабости и атрофии распространяются на мышцы дистальных отделов рук и ног.

Дородовая диагностика возможна в сегрегирующих семьях на основании изучения сцепления с ДНК-маркерами области хромосомы 12q24.
Инфантильная спинальная амиотрофия с параличом диафрагмы — SMARD
Впервые описали Mellins и соавт. в 1976 году. Тип наследования — аутосомно-рецессивный. Ген заболевания является геном иммуноглобулин-связывающего белка (IGHMBP2, MIM: 600502) и картирован на хромосоме 11q13-q13.4. Основное количество мутаций найдено в экзоне 5 (миссенс, нонсенс, сдвиг рамки считывания).
Заболевание составляет 1 % от всех случаев инфантильных спинальных амиотрофий. Первые проявления заболевания возникают с рождения или в периоде новорожденности и характеризуются симптомами вялого паралича или пареза, наиболее выраженными в мышцах дистальных отделов верхних конечностей. В ряде случаев первые признаки заболевания отмечаются еще во внутриутробном периоде и характеризуются снижением двигательной активности плода.
Дыхательные нарушения могут быть столь значительными, что требуют искусственной вентиляции легких и являются основной причиной гибели больных в возрасте до 3 месяцев. У большинства больных уже в период новорожденности формируются контрактуры в коленных и голеностопных суставах.
На ЭНМГ выявляются признаки поражения клеток переднего рога спинного мозга.

Истощение и гибель мотонейронов спинного мозга. В биоптате мышечных волокон выявляется феномен пучковой атрофии мышечных волокон без признаков реиннервации. Возможна дородовая диагностика.
Бульбоспинальная амиотрофия с глухотой (болезнь Брауна — Виалетто — ван Лэре)
У детей представлен аутосомно-рецессивный вариант SLC52A2; 8q24 с нарушением транспорта рибофлавина. Первые симптомы появляются в 2–5 лет. Выявляют билатеральную сенсоневральную глухоту, атрофию зрительного нерва, клинику поражения 7-й, 9–12-й пар черепных нервов (бульбарный синдром), фасцикуляции языка, гиповентиляцию.
С течением времени паралич распространяется на плечевой пояс, руки, грудную клетку. Возникает диафрагмальная слабость, отсутствуют рефлексы. Формируется сколиоз. ЭНМГ: денервация с элементами аксональной полиневропатии. Снижен уровень карнитина. В терапию необходимо включать рибофлавин 100–500 мг/день.
Бульбарный парез Фацио — Лонде
Эта форма представлена аутосомно-доминантным и аутосомно-рецессивным вариантами SLC52A3; 20p13. Заболевание возникает в возрасте от 1 года до 12 лет и характеризуется симптомами бульбарного паралича или пареза, слабостью лицевой мускулатуры, птозом и нарушением подвижности диафрагмы. При аутосомно-рецессивном варианте заболевания отмечаются прогрессирующий стридор, выраженные дыхательные расстройства, значительное слюнотечение, генерализованная гиперрефлексия, паралич диафрагмы.
Этот вариант характеризуется более ранним началом и злокачественным течением, приводящим к смерти больного в течение двух лет от начала заболевания. При аутосомно-доминантном типе наследования заболевание возникает позднее и характеризуется нерезко выраженными дизартрией и дисфагией, умеренным птозом, слабостью мышц лица, отсутствием дыхательных нарушений и медленным прогрессированием.
На ЭМГ выявляются признаки денервации и увеличение амплитуды М-ответа. При проведении патоморфологического исследования выявляются дегенерация и истощение нейронов черепно-мозговых нервов, спинного мозга и мозжечка.
Алгоритм диагностики СМА представлен на рис. 1.
Дифференциальная диагностика инфантильных и детских форм СМА
— Дефицит кислой мальтазы (гликогеноз II типа).
— Адренолейкодистрофия.
— Ботулизм.
— Наследственные мотосенсорные невропатии.
— Синдром Дауна.
— GM1-англиозидоз.
— Синдром Хурлера.
— Болезнь Гоше.
— Синдромы Марфана и Прадера — Вилли.
— Метаболические болезни (органические ацидурии и митохондриальные болезни).
— Неонатальная и врожденная миастения.
— Периферические невропатии.
— Гликогеноз (болезнь Помпе).
— Полиомиелит.
— Поражение спинного мозга.
Лечение СМА предполагает использование средств, направленных на сохранение мотонейрона (рилузол, вальпроевая кислота), улучшение энергетической обеспеченности (L-карнитин, коэнзим Q10), применение клеточной терапии.
Что это такое миопатия, симптомы ее характеризующие? Миопатии (мышечные дистрофии) — это обобщённое название целого ряда генетически детерминированных и приобретенных первичных мышечных дистрофий, в основе которых лежат нарушения различного характера в строении мышечной ткани и метаболизме, приводящие к прогрессирующему снижению мышечной массы, снижению силы мышц и ограничению двигательной активности (так называемый миопатический синдром).
К типичным признакам миопатий относятся: атрофия мышц (истончение мышечных волокон и частичное их замещение жировой тканью), резко прогрессирующая мышечная слабость, снижение тонуса мышц и сухожильных рефлексов. Миопатии могут передаваться при рождении по доминантному, аутосомно-рецессивному и сцепленному с полом типам.
Распространенность мышечных дистрофий аутосомно-рецессивных и аутосомно-доминантных форм в человеческой популяции варьирует от 0,9 до 32,6 случаев/100 тыс. населения. Как уже указывалось, миопатии представлены разнородными группами заболеваний мышечной ткани, в основе клинических проявлений которых лежит миопатический синдром. Краткая характеристика некоторых из них приведена ниже.
Врожденные миопатии
Включает широкий спектр генетически детерминированных заболеваний, которые различаются по времени манифестации клинической симптоматики, преимущественной локализации мышечных атрофии, темпу нарастания и характеру распространения патологических изменений, типу наследования. Наиболее тяжёлой группой этих заболеваний являются наследственные прогрессирующие мышечные дистрофии (ПМД), которые во многих случаях являются причиной ранней инвалидизации и приводят к летальному исходу.






